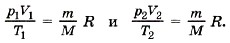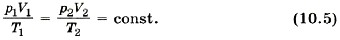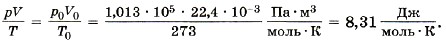|
|
|
|
|
Глава 10. Уравнение состояния идеального газа. Газовые законы § 63. Уравнение состояния идеального газаВ этой главе вы не встретите принципиально новых сведений о газах. Речь пойдёт о следствиях, которые можно извлечь из понятия температуры и других макроскопических параметров. Основное уравнение молекулярнокинетической теории газов вплотную приблизило нас к установлению связей между этими параметрами. Как можно рассчитать массу воздуха в кабинете физики? Какие параметры воздуха будут необходимы для определения этой массы? Мы детально рассмотрели поведение идеального газа с точки зрения молекулярно-кинетической теории. Была определена зависимость давления газа от концентрации его молекул и температуры (см. формулу (9.17)). На основе этой зависимости можно получить уравнение, связывающее все три макроскопических параметра р, V и Т, характеризующие состояние идеального газа данной массы.
Подставим в уравнение р = nkT выражение для концентрации молекул газа. Учитывая формулу (8.8), концентрацию газа можно записать так:
где NA — постоянная Авогадро, m — масса газа, М — его молярная масса. После подстановки формулы (10.1) в выражение (9.17) будем иметь
Подставляя в уравнение (10.2) вместо kNA универсальную газовую постоянную R, получаем
Единственная величина в этом уравнении, зависящая от рода газа, — это его молярная масса. Из уравнения состояния вытекает связь между давлением, объёмом и температурой идеального газа, который может находиться в двух любых состояниях. Если индексом 1 обозначить параметры, относящиеся к первому состоянию, а индексом 2 — параметры, относящиеся ко второму состоянию, то согласно уравнению (10.4) для газа данной массы
Правые части этих уравнений одинаковы, следовательно, должны быть равны и их левые части:
Известно, что один моль любого газа при нормальных условиях (р0 = 1 атм = 1,013 • 105 Па, t = 0 °С или Т = 273 К) занимает объём 22,4 л. Для одного моля газа, согласно соотношению (10.5), запишем:
Мы получили значение универсальной газовой постоянной R. Таким образом, для одного моля любого газа
Уравнение состояния не надо выводить каждый раз, его надо запомнить. Неплохо было бы помнить и значение универсальной газовой постоянной: R = 8,31 Дж/(моль • К). До сих пор мы говорили о давлении идеального газа. Но в природе и в технике мы очень часто имеем дело со смесью нескольких газов, которые при определённых условиях можно считать идеальными. Самый важный пример смеси газов — воздух, являющийся смесью азота, кислорода, аргона, углекислого газа и других газов. Чему же равно давление смеси газов? Для смеси газов справедлив закон Дальтона.
Вопросы к параграфу 1. Что называют уравнением состояния? 2. Какая форма уравнения состояния содержит больше информации: уравнение Клапейрона или уравнение Менделеева — Клапейрона? 3. Почему газовая постоянная R называется универсальной? 4. Сформулируйте закон Дальтона.
|
|
|



 Заметим, что формулой (9.17) можно пользоваться только до давления порядка 10 атм.
Заметим, что формулой (9.17) можно пользоваться только до давления порядка 10 атм.